Coinfecciones parasitarias: Influencia de las interacciones
Las coinfecciones parasitarias son habituales en la naturaleza y las interacciones entre diferentes especies de parásitos lo son igualmente. Hasta el momento, se han llevado a cabo muy pocos estudios sobre las interacciones que se propician durante esas coinfecciones, a pesar de su indudable influencia en la dinámica de las enfermedades parasitarias y sus consecuencias. En este trabajo se presentan apuntes generales acerca de diferentes aspectos relacionados con este fenómeno, así como algunos ejemplos de su relevancia tanto en sanidad animal como humana.

Schistosoma bovis, Fasciola hepática y Macho y hembra de Ornithodoros erraticus.
El parasitismo es uno de los estilos de vida más ampliamente extendidos en la naturaleza y el más popular en la tierra, pudiendo prácticamente cualquier organismo superior ser hospedador de alguna especie de parásito. Hospedadores y parásitos ejercen mutuamente procesos de selección natural como resultado de las batallas que libran y de la evolución de sus "armas" y "defensas". Los parásitos causan en la mayoría de las ocasiones enfermedades, denominadas parasitosis, a las que se enfrentan los demás organismos vivos.
Por ello, no es sorprendente que los parásitos hayan sido el blanco de las investigaciones relacionadas con la evolución de las enfermedades, contribuyendo así a comprender mejor el funcionamiento del sistema inmunitario y los mecanismos de protección frente a ellos.
Coinfecciones y poliparasitismo
Se asume que las diferentes especies de parásitos que colonizan a un determinado hospedador normalmente no interactúan porque a menudo parasitan tejidos diferentes, y el uso de recursos distintos limita la competición.
Sin embargo, recientes estudios epidemiológicos indican que la co-infección de un hospedador o alguna de sus células por más de un parásito se ve favorecida por la presencia previa de uno de esos parásitos, revelándose un fenómeno importante a nivel clínico y epidemiológico. El hallazgo de que la infección con un parásito aumenta la susceptibilidad a la infección por un segundo parásito tiene sentido siempre y cuando el hospedador esté expuesto a ambos parásitos en la naturaleza.
Factores medioambientales, espaciales, temporales o demográficos afectan a la frecuencia de la co-exposición a los parásitos.
Así, la mayor parte de las especies conocidas, incluido el hombre, pueden estar infectadas simultánea o secuencialmente por numerosas especies de parásitos. Este fenómeno, denominado poliparasitismo, tiene una gran influencia sobre la mortalidad, pero+ especialmente sobre la morbilidad de las especies afectadas, impactando sobre su estado nutricional, susceptibilidad frente a otras enfermedades, patologías asociadas, etc. (Pullan et al., 2008). El poliparasitismo tiene consecuencias no solo sobre el hospedador, sino también sobre los propios parásitos, afectando por ejemplo su virulencia.
Ya que el binomio parásito-hospedador no se puede descontextualizar de un tercer componente, que es el medio ambiente, podemos decir que el poliparasitismo tiene también un considerable interés a nivel ecológico y evolutivo (Graham et al., 2007 y 2008; Telfer et al., 2010).
Efectos del poliparasitismo sobre los parásitos: virulencia y competencia Las coinfecciones parasitarias tienen una gran influencia en la evolución de la virulencia -relacionada con la transmisión de parásitos- (Fellous and Coella. 2010). La virulencia previsiblemente aumenta cuando se incrementa el número de coinfecciones relacionadas. Así, es de esperar que exista una reproducción parasitaria más agresiva cuando la competición "dentro" del hospedador es más importante que "entre" hospedadores. A su vez, se ha visto que la virulencia también evoluciona de forma que los parásitos de transmisión vertical provocan un aumento en la virulencia de los parásitos de transmisión horizontal cuando ocurre la co-infección con ambos tipos de parásitos (Jones et al., 2010).
Los parásitos son consumidores y por tanto compiten por los recursos, pero también pueden competir por el establecimiento, crecimiento y reproducción en un hospedador determinado, siendo la competencia entre parásitos uno de los principales factores evolutivos para éstos. La competencia puede ser inter-especie (como en las infecciones mixtas por varias especies de helmintos) o intra-especie (como en las infecciones por plasmodios de distinto bagaje genético). Así, se ha visto que los helmintos pueden interaccionar estrechamente con otros helmintos, y también con virus, bacterias y protozoos en el mismo hospedador. Por ejemplo, existen evidencias de que los helmintos intestinales del género Acanthocephala desplazan a los vermes planos o platelmintos de los mejores sitios del intestino y compiten con ellos por los nutrientes. También los parásitos que causan la malaria (Plasmodium spp.) compiten con ciertos vermes por los glóbulos rojos del hospedador. Por ejemplo, algunos helmintos que se alimentan de sangre o que causan anemias, como las uncinarias o como Ascaris lumbricoides, provocan una disminución del número de eritrocitos, que afecta a los microparásitos que viven dentro de estas células y las necesitan para su multiplicación y supervivencia, fenómeno con importantes implicaciones en la salud humana (Graham et al., 2008; Melo et al., 2010). Un ejemplo de competencia intra-especie se encuentra entre distintas cepas de Trypanosoma brucei, el protozoo causante de la enfermedad del sueño en Ÿfrica. Generalmente, las cepas más virulentas son las ganadoras de la batalla, lo cual afecta no solo a la patología asociada, sino también a la dinámica de transmisión de estos parásitos y a la selección de determinadas cepas en zonas geográficas definidas (Balmer et al., 2009).
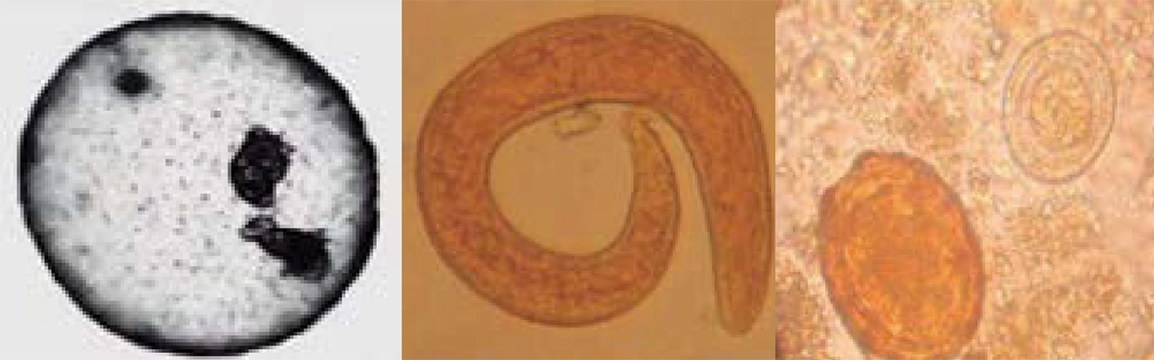
Quiste de Echinococcus obtenido in vitro, larva de nematodo rhabditiforme y huevos de Ascaris e Hymenolepis.
Los parásitos también pueden competir entre ellos a través de fenómenos de inmunidad cruzada, utilizando al sistema inmunitario del hospedador como un depredador para otros parásitos.
Las células T de memoria inducidas en respuesta a un parásito pueden reaccionarfrente a antígenos similares de otras especies parásitas. De este modo, puede aparecer inmunidad cruzada frente a un amplio rango de especies parasitarias tras una respuesta inmunitaria frente a una especie particular.
Un ejemplo es la protección observada en humanos frente a varias especies de Schistosoma tras la infección por una especie determinada. El fenómeno de la inmunidad cruzada es por tanto un factor importante que determina la diversidad de parásitos y patógenos que pueden infectan a un hospedador, y que por ello merece ser estudiado a fondo. Algunos autores ya han comenzado estos estudios, mostrando que el análisis de los anticuerpos que se generan contra antígenos parasitarios desglicosilados resulta útil para definir estas resistencias cruzadas (Fairlie-Clarke et al., 2010).
Al observar con más detalle estos fenómenos de competencia parasitaria, se encuentran consecuencias de esa competencia que pueden ser elevados a postulados generales, englobando conceptos ecológicos y de otra índole, como las evidencias crecientes que muestran que algunos parásitos de transmisión vertical persisten en la naturaleza porque pueden proteger a sus hospedadores de nuevas infecciones (Jones et al., 2011). Este fenómeno de protección frente a infecciones horizontales debido a una transmisión vertical tiene a su vez importantísimas implicaciones para las intervenciones en salud pública, tanto por aportar información relevante que evite, por ejemplo, tratamientos tempranos, como por afectar dichas interacciones cuando se desconocen sus consecuencias (Jones et al., 2007).
Coinfecciones y respuesta inmunitaria
Con frecuencia la capacidad de un parásito para establecerse en un hospedador depende de la respuesta inmunitaria innata del mismo, así como de otros factores como edad, genotipo, etc., aunque una vez establecida la infección, el parásito se encontrará con un ambiente inmunitario determinado por la infección actual y también por otras previas. Este ambiente, junto con la respuesta inmunitaria adaptativa, que puede ser efectiva frente a especies que presenten inmunidad cruzada, determinaran la susceptibilidad a la infección.
Como norma general, los vertebrados responden a las infecciones por microparásitos a través de respuestas T colaboradora (helper) tipo 1 (Th1) y mediante respuestas Th2 frente a macroparásitos, sintetizando las citocinas correspondientes a cada tipo de respuesta.
Dichas respuestas son a priori antagónicas (pro-inflamatorias/anti-inflamatorias),y usualmente si un tipo es estimulado al inicio de la infección, el otro es reprimido poniéndose en marcha mecanismos efectores distintos para combatir los diferentes tipos de infecciones.
Así, no es posible elaborar simultáneamente respuestas protectoras de ambos tipos frente a parásitos que coinfectan una misma localización anatómica, aunque sí podría conseguirse este fenómeno cuando encontramos los distintos parásitos en localizaciones físicas diferentes. Así, en el caso de coinfecciones por parásitos con distintas localizaciones anatómicas, las respuestas frente a los mismos pueden resultar perjudiciales para una de las especies parásitas. Pero este fenómeno no se produce solo cuando esas respuestas son antagónicas en el contexto Th1/Th2; también puede ocurrir entre parásitos que colonicen distintas localizaciones en el hospedador, aunque estimulen respuestas del mismo signo. Un ejemplo de los "efectos remotos" que pueden ocurrir entre parásitos que infectan diferentes tejidos es el caso de las ovejas infectadas por larvas de la mosca Oestrus ovis (cavidad nasal) y el nematodo Trichostrongylus colubriformis (intestino). En estos animales se observa una reducción en la carga parasitaria y número de huevos del nematodo respecto a ovejas parasitadas solamente por el helminto, siendo la reducción mayor si la infección por la mosca precede a la del helminto (Telfer et al., 2008). Los parásitos también pueden dar lugar a fenómenos de inmunosupresión, sobre todo en infecciones de carácter crónico. En ese caso, la interacción entre ese parásito y otros resultará en una sinergia que será beneficiosa para al menos uno de ellos. Ya existen numerosos estudios que demuestran con firmeza este tipo de asociaciones tanto positivas como negativas, entre parásitos, en relación a la respuesta inmune inducida por uno de ellos en el hospedador (Telfer et al., 2010).
Adicionalmente, las interacciones pueden ser consecuencia de los mecanismos efectores estimulados por cada parásito en combinación con los mecanismos de regulación cruzada de diferentes componentes del sistema inmunitario (Telfer et al., 2008). En el caso de las infecciones simultáneas por helmintos y microparásitos, la co-infección puede favorecer un aumento o un descenso del nivel de microparásitos dependiendo del grado de supresión de interferón-gamma, de los niveles de IgE y de interleucina-10, así como de la intervención de la vía CD23/NO de la respuesta inmune. Estos niveles influirán sobre la presentación de antígenos y la eliminación de patógenos y parásitos intracelulares y extracelulares, en un fenómeno de inmunomodulación que caracteriza a la relación parásito-hospedador (Nacher. 2008; Graham. 2008).
En ocasiones, ciertos parásitos pueden revertir la respuesta inducida por otros. Por ejemplo, la infección por Toxoplasma gondii resulta en la supresión de la respuesta Th2 en infecciones crónicas de Fasciola hepatica (Miller et al., 2009). En algunos casos, las infecciones por múltiples parásitos también pueden desembocar en enfermedades inmunopatológicas.
Como vemos, las respuestas inmunitarias del hospedador desempeñan un papel central influenciando interacciones entre parásitos que infectan un mismo individuo y determinando la duración y severidad de la infección.
Por tanto, el aspecto aplicado del conocimiento de estos fenómenos es también claro, ya que el sistema inmunitario del hospedador tiene memoria y puede mantener el impacto de una interacción incluso cuando el parásito/patógeno está ausente (Lello et al., 2008). Así, sería de gran importancia conocer y poder cuantificar las respuestas inmunitarias inducidas por los diferentes parásitos para posteriormente poder predecir la aparición de interacciones mediadas por el sistema inmunitario durante las coinfecciones (Fenton y Perkins, 2010). Impacto del poliparasitismo sobre la susceptibilidad del hospedador y la patogenia.
Las interacciones entre muchos microparásitos tienen gran impacto sobre la susceptibilidad del hospedador, aumentándola o disminuyéndola frente a la misma infección o frente a otras infecciones
El riesgo de infección depende de la probabilidad de adquirir una dosis infectiva y de que esa dosis resulte en una infección real después de la exposición (susceptibilidad del hospedador). Las interacciones entre muchos microparásitos tienen gran impacto sobre la susceptibilidad del hospedador, aumentándola o disminuyéndola frente a la misma infección o frente a otras infecciones dependiendo del caso (Telfer et al., 2010). Por ejemplo, se ha comprobado que se produce un fuerte descenso en la susceptibilidad frente a una infección por hemoparásitos cuando existe una infección por helmintos, debido a la competencia de nutrientes/nicho (hematíes) entre ellos, tal y como hemos mencionado.
Por otra parte, recientemente se ha resaltado cómo la severidad de una enfermedad causada por un parásito puede ser alterada por la presencia de un segundo agente infeccioso, incluyendo parásitos (Pullan et al., 2008).
Por ejemplo, se ha visto que las preinfecciones por nematodos intestinales pueden disminuir la patología inflamatoria inducida por huevos de esquistosomas (Bazzone et al., 2008). Un ejemplo de la interacción de los parásitos con otros agentes infecciosos se encuentra en la co-infección de pollos por cryptosporidios y por el virus causante de la enfermedad de Marek, los cuales muestran un aumento en la severidad de ambas enfermedades comparado con individuos infectados por cada uno de los agentes infecciosos por separado (Abbassi et al., 2000).
Recientemente se ha demostrado la coinfección de células del sistema inmunitario (macrófagos) por Toxoplasma gondii y Leishmania infantum, lo cual puede causar diferentes manifestaciones clínicas dependiendo del estado inmunitario del hospedador (Christodoulou et al., 2011). Todo ello pone de manifiesto la enorme importancia que también pueden ejercer las coinfecciones y sus interacciones a nivel de la patología clínica y duración de las enfermedades parasitarias.
Otras implicaciones del fenómeno de poliparasitismo en salud pública
Los efectos del poliparasitismo son también evidentes en campos tan importantes de la salud pública como la prevención, el tratamiento y el diagnóstico de enfermedades infecciosas. En las infecciones mixtas el tratamiento frente a un parásito puede no restablecer la salud del paciente, si el parásito competidor responde para compensar la ausencia del tratado. Por ello, se deben tener en cuenta la posible exacerbación de ciertas enfermedades parasitarias al eliminar sus competidores, especialmente en programas de control dirigidos frente a helmintos y microparásitos. Cuantificando la importancia de las interacciones entre parásitos y sus hospedadores se podrían ajustar mejor los correspondientes tratamientos frente a determinadas especies parásitas, siendo extremadamente importante en este contexto el conocimiento de las interacciones entre comunidades de parásitos, y no los estudios de interacciones parásito-hospedador que no consideran la existencia de otros parásitos en esa relación.
Así mismo, las implicaciones derivadas de la modulación/inducción de ciertos tipos de respuestas inmunitarias por parte de los parásitos en sus asociaciones tienen efectos sobre la eficacia de las vacunas utilizadas en sanidad animal y humana, que podrían resultar también en la exacerbación de ciertas patologías parasitarias (Frantz et al., 2010), y que se deberían tener en cuenta a la hora de desarrollar nuevas vacunas. En humanos, las consecuencias del poliparasitismo se conocen muy poco, pudiendo llegar a ser muy importantes, especialmente en los grupos vulnerables como niños y mujeres embarazadas de zonas tropicales y subtropicales. Por todo ello, es necesario realizar una investigación sistemática del fenómeno de las coinfecciones parasitarias para conocer el impacto del mismo.
Agradecimientos para la doctora Nidia Sandoval y el Laboratorio de Parasitología Ambiental de la Universidad de Panamá por varias de las fotos que se muestran en este trabajo.
Bibliografía
Abbassi H, Dambrine G, Chérel Y, Coudert F, Naciri M. Interaction of Marek's disease virus and Cryptosporidium baileyi in experimentally infected chickens. Avian Dis. 2000 Oct-Dec;44(4):776-89.
Balmer O, Stearns SC, Schötzau A, Brun R. Intraspecific competition between co-infecting parasite strains enhances host survival in African trypanosomes. Ecology. 2009 Dec;90(12):3367-78.
Bazzone LE, Smith PM, Rutitzky LI, Shainheit MG, Urban JF, Setiawan T, Blum AM, Weinstock JV, Stadecker MJ. Coinfection with the intestinal nematode Heligmosomoides polygyrus markedly reduces hepatic egginduced immunopathology and proinflammatory cytokines in mouse models of severe schistosomiasis. Infect Immun. 2008 Nov;76(11):5164-72.
Christodoulou V, Messaritakis I, Svirinaki E, Tsatsanis C, Antoniou M. Leishmania infantum and Toxoplasma gondii: Mixed infection of macrophages in vitro and in vivo. Exp Parasitol. 2011 Feb 24.
Fairlie-Clarke KJ, Lamb TJ, Langhorne J, Graham AL, Allen JE. Antibody isotype analysis of malaria-nematode co-infection: problems and solutions associated with cross-reactivity. BMC Immunol. 2010 Feb 17;11:6.
Fellous S, Koella JC. Cost of co-infection controlled by infectious dose combinations and food availability. Oecologia. 2010 Apr;162(4):935-40.
Fenton A, Perkins SE. Applying predator-prey theory to modelling immune-mediated, within-host interspecific parasite interactions. Parasitology. 2010 May;137(6):1027-38.
Frantz FG, Rosada RS, Peres-Buzalaf C, Perusso FR, Rodrigues V, Ramos SG, Kunkel SL, Silva CL, Faccioli LH. Helminth coinfection does not affect therapeutic effect of a DNA vaccine in mice harboring tuberculosis. PLoS Negl Trop Dis. 2010 Jun 8;4(6):e700.
Graham AL, Cattadori IM, Lloyd-Smith JO, Ferrari MJ, Bjμrnstad ON. Transmission consequences of coinfection: cytokines writ large? Trends Parasitol. 2007 Jun;23(6):284-91.
Graham AL. Ecological rules governing helminth-microparasite coinfection. Proc Natl Acad Sci U S A. 2008 Jan 15;105(2):566-70.
Helmby H. Gastrointestinal nematode infection exacerbates malaria-induced liver pathology. J Immunol. 2009 May 1;182(9):5663-71.
Jones EO, White A, Boots M. Interference and the persistence of vertically transmitted parasites. J Theor Biol. 2007 May 7;246(1):10-7.
Jones EO, White A, Boots M. The evolutionary implications of conflict between parasites with different transmission modes. Evolution. 2010 Aug;64(8):2408-16.
Jones EO, White A, Boots M. The evolution of host protection by vertically transmitted parasites. Proc Biol Sci. 2011 Mar 22;278(1707):863-70.
Lafferty KD. Microbiology. Interacting parasites. Science.
2010 Oct 8;330(6001):187-8.
Lello J, Norman RA, Boag B, Hudson PJ, Fenton A.
Pathogen interactions, population cycles, and phase
shifts. Am Nat. 2008 Feb;171(2):176-82.
Melo GC, Reyes-Lecca RC, Vitor-Silva S, Monteiro WM,
Martins M, Benzecry SG, Alecrim MG, Lacerda MV.
Concurrent helminthic infection protects schoolchildren with Plasmodium vivax from anemia. PLoS One. 2010 Jun 21; (6):e11206.
Miller CM, Smith NC, Ikin RJ, Boulter NR, Dalton JP,
Donnelly S. Immunological interactions between 2 common pathogens, Th1-inducing protozoan Toxoplasma gondii and the Th2-inducing helminth Fasciola hepatica. PLoS One. 2009 May 25;4(5):e5692.
Nacher M. Interactions between worm infections and malaria. Clin Rev Allergy Immunol. 2004 Apr;26(2):85- 92.
Pullan R, Brooker S. The health impact of polyparasitism in humans: are we under-estimating the burden of parasitic diseases? Parasitology. 2008 Jun;135(7):783- 94. Epub 2008 Mar 27.
Telfer S, Birtles R, Bennett M, Lambin X, Paterson S, Begon M. Parasite interactions in natural populations: insights from longitudinal data. Parasitology. 2008 Jun;135(7):767-81.
Telfer S, Lambin X, Birtles R, Beldomenico P, Burthe S, Paterson S, Begon M. Species interactions in a parasite community drive infection risk in a wildlife population. Science. 2010 Oct 8;330(6001):243-6.
Papers
Papers





